Materia care ne înconjoară nu este continuă. Este format din particule microscopice, care împreună alcătuiesc doar un întreg. În acest moment ajungem la teoria atomică ale cărei baze sunt puse în curentele filozofice ale antichității. Ce este porumbul? Din ce este făcut și cum este făcut? Este divizibil? Răspundem la acestea și la alte întrebări mai jos.
Omul a încercat să înțeleagă structura materiei din timpuri imemoriale. În cele mai vechi timpuri, opinia predominantă era că tot ceea ce ne înconjoară este format din particule mici care nu pot fi împărțite. Autorul ei trebuia să fie Democrit. Totuși, aceasta nu a fost o teorie bazată pe experiență, ci doar un concept filozofic. Lumea a trebuit să aștepte până în secolul al XIX-lea pentru confirmarea științifică a structurii atomului.
Cuvântul „atom” provine din greacă (porumb) și înseamnă ceva ce nu poate fi împărțit. Deși nomenclatura a supraviețuit din cele mai vechi timpuri până în cele moderne, astăzi știm că esența sa nu are nimic de-a face cu faptele științifice.
Ce este porumbul? Când vorbim despre asta, trebuie să te referi la cea mai mică particulă a unui element chimic care își prezintă proprietățile. Toate elementele sunt formate dintr-un singur tip de atom. Carbonul este format din atomi de carbon, iar plumbul este format din atomi de plumb. Cel mai important, indiferent din ce element sunt formați, atomii sunt alcătuiți din aceleași particule. Ele diferă doar prin numărul lor. Acest lucru este suficient pentru a crea elemente chimice care prezintă proprietăți complet diferite.
Din ce particule este format un atom? Mai mult de 99,9% din masa unui atom este conținută în nucleul atomic. Restul sunt electroni. Nucleul atomic în sine este format din protoni încărcați pozitiv, al căror număr este egal cu numărul de electroni din atom și – cu excepția celui mai simplu nucleu de hidrogen – din neutroni neutri din punct de vedere electric. Aceste particule se numesc nucleoni.

Literal, fiecare particulă enumerată definește existența materiei. Atomii sunt neutri din punct de vedere electric (altfel ar deveni ioni) din cauza protonilor pozitivi care echilibrează electronii negativi. Pe de altă parte, neutronii acționează ca izolatori ai sarcinii pozitive. Ei echilibrează forța de repulsie a protonilor și astfel împiedică destabilizarea nucleului.
Însăși traducerea cuvântului „atom” indică indivizibilitatea acestei particule. Astăzi știm că ipoteza pe care s-a bazat inițial teoria atomică a fost greșită. Deoarece atomii nu au o structură uniformă, aceasta înseamnă că sunt divizibili.
William Prout a fost primul care a vorbit despre scindarea atomului în 1815. Medicul englez a presupus că toți atomii sunt formați din atomi de hidrogen. Ipoteza sa a fost respinsă, dar experiența ulterioară a dovedit că avea dreptate în privința divizibilității în sine.
O descoperire în studiul structurii atomului a avut loc în 1897, când Joseph John Thomson a determinat raportul dintre sarcină și masa particulelor încărcate negativ din radiația catodică. Un alt punct de cotitură datează din 1898. Este vorba despre descoperirea poloniului și a radiului de către coreeni. Cercetările care vizează separarea cantităților vizibile de radiu au stabilit că radiația emisă este formată din atomi de heliu ionizat (așa-numitele particule alfa), electroni și raze X. Atomul s-a spulberat și s-a format ca urmare.
De-a lungul anilor, aproximativ structura atomului S-au făcut multe teze. Una dintre cele mai vechi a fost propusă de William Thomson, descoperitorul temperaturii zero absolut și a celei de-a doua lege a termodinamicii. Mai târziu, modelul său a fost ilustrat de deja menționatul Joseph John Thompson. În ipoteza lor, atomul ar fi trebuit să aibă o structură sferică încărcată pozitiv, în care electronii încărcați negativ se mișcau simetric în jurul centrului său.
Ernest Rutherford a propus un alt model. Pe baza experimentului de împrăștiere a particulelor alfa (adică a nucleelor de heliu) pe folie de aur, el a ajuns la concluzia că fluxul lor este dispersat în mare parte de atomii de aur, ceea ce contrazice presupunerile lui Thomson, care indicau interacțiuni electrice neglijabile. Rutherford a presupus că nucleul încărcat pozitiv este centrul atomului, iar electronii încărcați negativ se rotesc în jurul lui.
Acest așa-zis model planetar avea însă o slăbiciune importantă. Conform ipotezelor electrodinamicii lui Maxwell, particulele încărcate electric care se mișcă constant în jurul unei particule încărcate opus produc energie sub formă de radiație electromagnetică. Prin urmare, modelul planetar nu poate fi corect, deoarece, conform ipotezelor sale, după un timp electronii vor cădea pe nucleu, destabilizand materia.
Niels Bohr a concluzionat că modelul lui Rutherford a fost corect, dar că a fost greșit să se aplice ipotezele fizicii clasice. În lucrarea sa, el a concluzionat că electronii nu eliberează energie în mod continuu, ci ocupă orbite cu distanțe strict definite față de nucleu. Bohr a postulat că un electron nu poate decât să accepte sau să renunțe Anumite cantități de energie, adică cantități. Acest lucru ar trebui să ducă la o schimbare a orbitei sale.
Au urmat alte lucrări:
- Teoria lui Louis de Broglie a naturii ondulatorii-corpusculare a particulelor elementare,
- Introducerea funcțiilor de undă pentru particulele elementare de Erwin Schrödinger,
- O introducere în conceptul de densitate de probabilitate de Max Born,
- O introducere în principiul incertitudinii de Werner Heisenberg.
Ei au făcut posibilă crearea unei imagini a unui atom pe care știința îl folosește până în prezent.
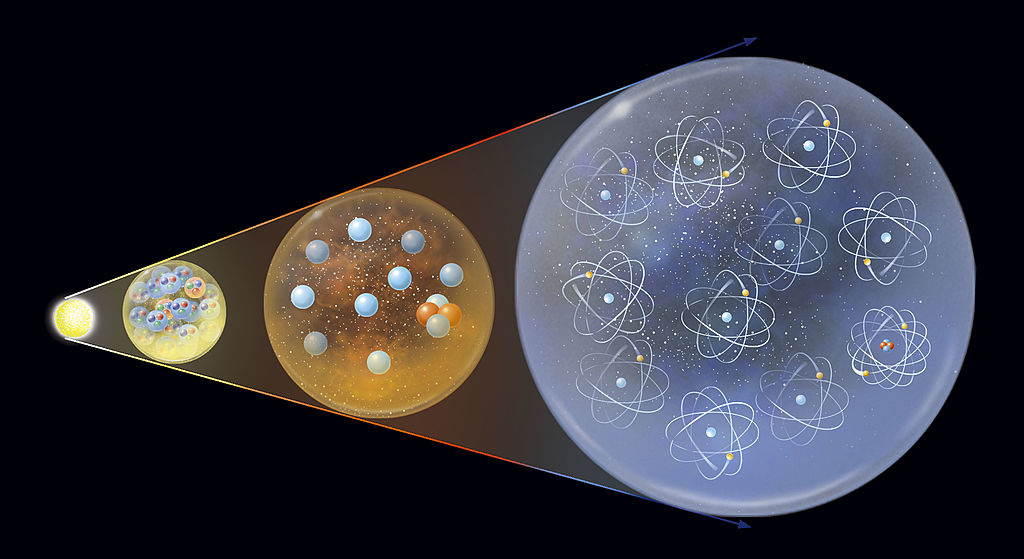
Pentru a explica procesul prin care se formează atomii, trebuie să ne întoarcem la început Univers. Imediat după Big Bang, întregul univers a fost umplut cu nori de materie cuarc-gluoni. Pe măsură ce densitatea sa a început să scadă, universul a început să se extindă și să se răcească. Ca urmare, energia particulelor a început să scadă. Aceștia au început să comunice între ei. Quarcii au alcătuit protonii și neutronii, iar aceștia au format nucleele atomice. Aceste particule au început să capteze electroni, ceea ce a dus la formarea primilor atomi.
La început, doar cele mai ușoare elemente, cum ar fi hidrogenul, heliul și litiul, erau prezente în univers. Cele puțin mai grele, cum ar fi oxigenul, carbonul sau fierul, s-au format numai atunci când s-au format stelele, iar în ele există energie care permite acest proces să aibă loc. În orice caz, așa se formează încă elementele în spațiu.
Dar elementele mai grele decât fierul, cum ar fi aurul? Aceasta a fost creată în urma Explozie de supernova. Marea energie a stelelor masive a permis materiei să se răspândească în tot universul. O parte din ea a format noi corpuri cerești, inclusiv Teren.
Un atom este adesea asociat cu cea mai mică particulă a unui element. Aceasta este o simplificare uriașă, deoarece un atom este într-adevăr cea mai mică particulă, dar păstrează proprietățile unui anumit element. Există lucruri mai mici în natură. Faptul că un atom nu este o particulă fără o structură internă indică în mod clar că trebuie să existe ceva mai mic și chiar este.
Mai mici decât un atom sunt particulele elementare, adică cele din care sunt alcătuiți atomii. Atomul însuși este format dintr-un nucleu și electroni care orbitează în jurul lui. Nucleul atomic este format din neutroni și protoni. Totuși, și acestea Particulele elementare sunt divizibile. Este format din quarci „d” și „u”.
Există și alte tipuri de quarci care pot fi produse în laborator. Proprietățile asemănătoare electronilor sunt prezentate de tuns, muoni și neutrini. Există, de asemenea, bozoni, fotoni și gluoni care sunt responsabili pentru interacțiunea dintre toate particulele. Este imposibil să nu menționez asta bosonul Higgs – o particulă responsabilă pentru masa diferită de zero a altor particule.
În cele din urmă, este potrivit să explicăm cine a descoperit de fapt atomul. În 1808, John Dalton a creat teoria atomică modernă. Omul de știință englez a presupus că materia este formată din atomi indivizibili – bile elastice de dimensiuni microscopice.
Până în secolul al XIX-lea, mulți savanți au pus sub semnul întrebării presupunerile lui Dalton. Doar teoria cinetic moleculară a gazelor, dezvoltată de Maxwell și Boltzmann, ne-a permis să acceptăm corectitudinea ipotezelor despre structura atomică a materiei. Alte dovezi au venit în 1827, când Robert Brown a observat mișcarea continuă a particulelor de praf de Venus suspendate într-un lichid (mișcarea browniană). Lucrarea lui Łukasz Bodaszewski a fost de asemenea importantă. În 1882, un fizician polonez a observat o mișcare similară a suspensiilor în gaze.

„Creator. Bursă de alcool. Maven web extrem de umil. Scriitor rău. Tv ninja.”